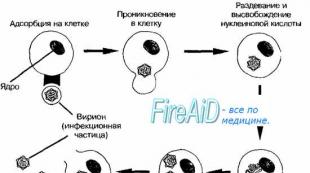
Stadien der Virusreproduktion. Eindringen in die Zelle
Vermehrung von Viren in Zellen- Eine produktive Infektion ist ein einzelner Prozess, der bedingt in mehrere Phasen unterteilt ist:
1. Adsorption von Virionen am Hahnloch
2. Eindringen von Viren in die Zelle
3. Deproteinisierung des Virions und Freisetzung seiner Nukleinsäure (Genom)
4. Expression des viralen Genoms, Synthese von Virionkomponenten (Transkription, Translation, Replikation)
5. Bildung von Virionen
6. Freisetzung einer neuen Generation von Virionen aus der Zelle
Die ersten 3 Phasen sind vorbereitend. Die tatsächliche Reproduktion stammt aus Stufe 4.
1. Die Adsorption von Virionen an der Zelle erfolgt in Gegenwart spezifischer Rezeptoren. Bei einfachen Viren gibt es Oberflächenbindungsproteine; bei komplexen Viren übernehmen Glykoproteine die Rolle der Bindungsproteine, die Stacheln auf dem Superkapsid bilden.
Rezeptoren auf der Oberfläche der Zellmembran können unterschiedlicher Natur sein, ihre Zahl erreicht 10 4 oder mehr pro Zelle. Die Adsorption beginnt unspezifisch und setzt sich spezifisch fort (das Virus wird „erkannt“ und bindet an einen komplementären Rezeptor). Der Tropismus von Viren ist die selektive Zerstörung von Zellen und Geweben in bestimmten Arten von Organismen (das Vorhandensein komplementärer Rezeptoren auf ihnen).
2. Eindringen von Virionen in die Zelle
Durch Rezeptorendozytose ( viropexis) – an der Stelle der Virusadsorption entsteht ein Endosom (Invagination), das das Virus enthält. Es verbindet sich mit dem zellulären Lysosom und der Vakuole und bildet ein Rezeptosom (sowohl einfache als auch falsche Viren dringen auf diese Weise ein).
- durch Verschmelzung der Superkapsidmembranen des Virus und der Zelle. Wird durch Fusionsproteine durchgeführt. Das Nukleokapsid landet im Zytoplasma der Zelle. Charakteristisch für komplexe Viren, die über F-Fusionsproteine oder andere Glykoproteine verfügen (z. B. Hämagglutinin des Influenzavirus).
- Eine Kombination ist möglich.
3. Deproteinisierung von Viren („Entkleiden“). Ziel ist die Freisetzung von Nukleinsäure, um die Virusvermehrung anzuregen.
Viren, die durch Rezeptorendozytose in die Zelle gelangt sind, verlassen das Rezeptosom durch Membranfusion (komplexe Viren) oder unter Beteiligung von Kapsidoberflächenproteinen (einfache Viren). In diesem Fall erfolgt die teilweise Deproteinisierung durch lysosomale Enzyme und Enzyme der Receptosomenmembran. Die „Entkleidung“ setzt sich im Zytoplasma durch Proteasen und andere zelluläre Enzyme fort.
Wenn ein Virus durch Membranfusion in eine Zelle eindringt, beginnt beim Eintritt die Deproteinisierung mit Hilfe von Zellmembranenzymen. Setzt sich im Zytoplasma fort.
Die Freisetzung des Genoms kann vollständig oder unvollständig sein (interne Proteine oder Kapsidproteine bleiben zurück, die anschließend die Nukleinsäure vor zytoplasmatischen Nukleasen schützen).
4. Expression des viralen Genoms. Manchmal ist ein Transport zum Kern erforderlich.
A) Transkription – die Bildung komplementärer mRNA auf der Genommatrix
B) Übersetzung – Übersetzung genetischer Informationen von mRNA in eine Aminosäuresequenz. mRNA wird an zellulären Ribosomen durchgeführt, wobei die Synthese zellulärer Proteine unterdrückt wird. Virale Proteine können gebildet werden: aus kurzer monocistronischer mRNA (einzelne Proteine, auf Ribosomen), aus langer polycistronischer mRNA (Riesenpolypeptid, auf Polysomen, anschließend in einzelne Proteine geschnitten).
Besonderheiten:
- Viren mit doppelsträngiger DNA: genomische DNA -> Transkription -> mRNA -> Translation -> Protein (zuerst früh nichtstrukturell, dann spät strukturell)
Es wird im Zellkern (bei den meisten Viren) durch zelluläre Transkriptase und im Zytoplasma durch virale Transkriptase durchgeführt.
RNA – genomische RNA zugleich i-RNA: genomisch + RNA > Übersetzung > Protein (ein riesiges Polypeptid, das von Proteasen zerschnitten wird)
- minus RNA: genomisch –RNA > Transkription > mRNA > Übersetzung > Protein
erfolgt durch eigene Transkriptasen
Retroviren (onkogene Viren und Erreger der HIV-Infektion) – ein diploides Genom aus zwei identischen Einzelsträngen + RNA und Reverse Transkriptase (derselbe Übertragungsweg ist beim Hepatitis-B-Virus und der durch Zecken übertragenen Enzephalitis möglich: genomische RNA > Provirus (komplementäre DNA). ) > Transkription > mRNA > Übersetzung > Protein
Replikation: Synthese vieler identischer Kopien auf der Matrix des ursprünglichen Genoms des Virus. Im Zellkern (meistens) und im Zytoplasma. Der Prozess beginnt nach der Anhäufung nichtstruktureller früher Proteine. Durchgeführt durch virale zelluläre Polymerasen. Sofort komplett umgesetzt.
In doppelsträngigen DNA-Genomen – unter Verwendung einer Replikase vom halbkonservativen Typ, ähnlich der zellulären DNA
Einzelsträngiges +RNA-Genom – unter Verwendung virusinduzierter RNA-Polymerase. Auf der ursprünglichen +RNA wird –RNA (ein doppelsträngiger Zwischenreplikationskomplex) gebildet, der abgespalten wird, und darauf entsteht +RNA, identisch mit der ursprünglichen. Es kommt zur Anhäufung mehrerer Kopien des Genoms.
Einzelsträngiges – RNA-Genom – mit Hilfe der RNA-abhängigen RNA-Polymerase, auch durch einen doppelsträngigen Zwischenreplikationskomplex
Retroviren durchlaufen die gleichen Stadien wie bei der Transkription, mit der obligatorischen Replikation proviraler DNA in das Zellchromosom. Kopien einzelsträngiger +RNA werden auf der proviralen DNA-Matrize repliziert.
Retroviren zeichnen sich durch eine Kombination aus integrativer und produktiver Infektion aus (wobei die integrative Infektion vorherrscht und eine Persistenz des Virus beobachtet wird).
Durch die Expression reichern sich Kopien viraler Genome und Strukturproteine in der Zelle an. Diese Prozesse finden in verschiedenen Teilen der Zelle statt und diese Fortpflanzungsmethode wird als disjunktiv bezeichnet.
5. Bildung von Virionen aus Virusbestandteilen. Im Zytoplasma.
Einfache Viren: leere Selbstorganisation, ein Kapsid wird spiralförmig oder kubisch gebildet. Das Ergebnis ist ein Nukleokapsid.
Komplexe Viren entstehen in mehreren Stadien. Es entsteht ein Nukleokapsid, dann interagieren sie mit veränderten Zellmembranen, werden in eine Superkapsidhülle gekleidet und bei manchen Viren bildet sich eine M-Schicht unter dem Superkapsid.
6. Austritt von Virionen aus der Zelle
Während der Zelllyse („explosiver Typ“, typisch für einfache Viren)
Durch Knospung (komplexe Viren erwerben gleichzeitig ein Superkapsid). Die Zelle stirbt nicht sofort; es gelingt ihr, neue Generationen von Viren freizusetzen, bevor ihre Ressourcen erschöpft sind.
Inhaltsverzeichnis zum Thema „Arten von Mikroorganismen. Viren. Virion.“:1. Mikroorganismen. Arten von Mikroorganismen. Klassifizierung von Mikroorganismen. Prionen.
2. Viren. Virion. Morphologie von Viren. Virusgrößen. Nukleinsäuren von Viren.
3. Viruskapsid. Funktionen des viralen Kapsids. Kapsomere. Nukleokapsid von Viren. Spiralsymmetrie des Nukleokapsids. Kubische Symmetrie des Kapsids.
4. Superkapsid des Virus. Gekleidete Viren. Nackte Viren. Matrixproteine (M-Proteine) von Viren. Reproduktion von Viren.
5. Interaktion des Virus mit der Zelle. Die Art der Virus-Zell-Interaktion. Produktive Interaktion. Virogenie. Einmischung von Viren.
7. Eindringen des Virus in die Zelle. Viropexis. Den Virus entkleiden. Schattenphase (Finsternisphase) der Virusvermehrung. Bildung viraler Partikel.
8. Transkription des Virus in der Zelle. Virus Übertragung.
9. Replikation des Virus in der Zelle. Zusammenbau von Viren. Freisetzung von Tochtervirionen aus der Zelle.
Basierend auf der Art der Interaktion des Virusgenoms mit dem Zellgenom werden sie unterteilt in autonom(das Virusgenom ist nicht in das Zellgenom integriert) und Integration(das Genom des Virus wird in das Genom der Zelle integriert) Infektion. Es wird eine Sonderform zusammengestellt latente und anhaltende Infektion.
Latente Infektion von Zellen durch Viren. Die DNA einiger Viren (Herpesviren, Retroviren) kann sich außerhalb der Chromosomen in der Zelle befinden oder die virale DNA ist in das Kerngenom integriert, virusspezifische Synthesen finden jedoch nicht statt. Diese virale DNA bildet ein latentes Provirus, das sich zusammen mit dem Chromosom repliziert. Solche Zustände der viralen DNA sind instabil; periodische Reaktivierungen sind mit dem Übergang zu einer produktiven Virus-Zell-Interaktion möglich, oder die Zelle wird transformiert, was zu bösartigem Wachstum führt.
Anhaltende Infektion von Zellen durch Viren. Einige RNA-Viren können persistierende Infektionen verursachen, die sich durch die Bildung von Tochterpopulationen des Erregers nach Abschluss der akuten Krankheitsphase äußern. In diesem Fall kommt es zu einer allmählichen Freisetzung von Viruspartikeln, die infizierte Zelle wird jedoch nicht lysiert. Häufig sind die Tochterpopulationen der Virionen defekt (was häufig bei immungeschwächten Personen beobachtet wird). Manchmal treten solche chronischen Läsionen ohne klinische Manifestationen auf. Insbesondere das Hepatitis-B-Virus kann zu einer dauerhaften Schädigung der Hepatozyten mit der Entwicklung einer chronischen Hepatitis führen; In Zukunft ist eine Zellmalignität möglich.
Fortpflanzungszyklus von Viren
In Abb. dargestellt. 2-3 Stadien der Reproduktion(von der Adsorption von Virionen bis zur Freisetzung der Tochterpopulation) treten während der produktiven Interaktion des Virus mit der Zelle auf.
 Reis. 2-3. Die Hauptstadien der Virusreproduktion.
Reis. 2-3. Die Hauptstadien der Virusreproduktion.
Adsorption des Virions an die Zelle
Die erste Stufe des Fortpflanzungszyklus ist Adsorption von Virionen auf der Oberfläche der infizierten Zelle. Die Adsorption erfolgt durch Interaktion des Virions mit spezifischen zellulären Rezeptoren. Proteine, aus denen das Kapsid oder Superkapsid besteht, sind für die Rezeptorerkennung verantwortlich. Somit wird das Konzept des „viralen Tropismus“ durch die spezifische Interaktion viraler Proteine mit den Oberflächenrezeptoren der infizierten Zelle erklärt. Beispielsweise dringt das Poliovirus in die Zellen des Zentralnervensystems (ZNS) und des Magen-Darm-Trakts (GIT) ein und vermehrt sich dort, da bei Menschen und Primaten nur diese Zellen über Rezeptoren für Poliovirus-Proteine verfügen.
Adsorptionsprozess hängt nicht von der Temperatur ab (d. h. erfordert keinen Energieaufwand) und erfolgt in zwei Phasen; Die ionische Anziehungsphase wird durch eine unspezifische Wechselwirkung verursacht, die Anlagerungsphase erfolgt aufgrund der strukturellen Homologie oder Komplementarität der interagierenden Moleküle.
Die Anzahl der an der Zelle adsorbierten infektiösen Viruspartikel bestimmt den Begriff „ Vielzahl von Infektionen"(Infektion). Typischerweise enthält eine tierische Zelle etwa 50.000 Rezeptoren und ihre Infektion ist vielfältig, das heißt, eine große Anzahl von Virionen kann an der Zelle adsorbiert werden. Allerdings ist eine mit einem Virus infizierte Zelle normalerweise tolerant gegenüber einer erneuten Infektion durch ein homologes Virus.
1. Allgemeine Vorstellung von der Virusreproduktion.
2. Arten der Interaktion zwischen Viren und Zellen.
3. Interaktion je nach Art der akuten Infektion.
4. Zytozide Infektion und Zelltod.
5. Zellreaktion auf eine Virusinfektion.
Im Lebenszyklus von Viren wird Nukleinsäure kopiert, gefolgt von der Synthese viraler Proteine und der Selbstorganisation der Komponenten zu einem reifen Viruspartikel und dem Austritt aus der infizierten Zelle. Dieser Vorgang wird Reproduktion genannt.
Nachdem das Virus in die Wirtszelle eingedrungen ist und die Nukleinsäure aus den Virionhüllen freigesetzt hat (und die Zelle infiziert), erkennt das Virusgenom sein pathogenes Potenzial, wodurch mRNA auf dem viralen Nukleinsäuremolekül synthetisiert wird, das die Synthese reguliert das virusspezifische Protein. Anschließend erfolgt die Replikation der viralen Nukleinsäure (Synthese einer großen Anzahl von Nukleinsäurekopien), die unter Bildung reifer Virionen in ein Kapsid aus zuvor synthetisierten virusspezifischen Proteinen gekleidet wird.
Die Synthese von mRNA (Translation) und Nukleinsäurekopien (Replikation) erfolgt mithilfe von Enzymen, sogenannten Polymerasen (Replikasen), die entweder virusspezifisch (vom viralen Genom kodiert und während des Reproduktionsprozesses synthetisiert) oder virusspezifisch sein können zellulär (Teil der Zelle und von Viren für ihre eigene Fortpflanzung verwendet).
Bei der Vermehrung von Viren bleiben folgende Muster erhalten:
1. Die Monomerquelle für Nukleinsäuren sind Zellnukleotide (Desoxyribonukleotidphosphate und Ribonukleotidphosphate).
2. Aminosäuren sind die Monomerquelle für Proteine
3. Die Synthese viraler Proteine erfolgt an den Ribosomen der Wirtszelle und hängt nicht von der Synthese viraler Nukleinsäure ab.
4. Zell-ATP dient als Energiequelle für die Synthese.
Die Virusvermehrung erfolgt in mehreren Phasen:
I. Ereignisse, die zur Adsorption, dem Eindringen des Virus in die Zelle, der Freisetzung des viralen Genoms und dessen Veränderung in einer Weise führen, dass es in der Lage wird, die Entwicklung einer Infektion auszulösen. Diese Phase wird aufgerufen Infektionsphase. Es enthält:
1. Adsorption des Virus an der Zelle.
2. Eindringen des Virus in die Zelle.
3. Deprotenisierung (Entkleidung des Virus).
II. Das Stadium der Fortpflanzung, in dem es auftritt virale Genomexpression. Es enthält:
1. Transkription.
2. Ausstrahlung.
3. Genomreplikation.
4. Zusammenbau der Virion-Komponenten.
5. Austritt des Virus aus der Zelle.
Wenn ein Virus mit einer Zelle interagiert, entsteht eine Infektion, und die Formen dieser Interaktion können unterschiedlich sein.
Es gibt zwei Formen der Interaktion zwischen dem Virus und der Zelle (abhängig von der Verweildauer in der Zelle und der Genomstrategie):
I. Autonome Art der Interaktion.
In diesem Fall funktioniert das virale Genom autonom vom Zellgenom. Viren, die sich autonom vermehren, werden klassifiziert als virulent.
Auf Zellebene Diese Art der Interaktion kann folgende Formen annehmen:
1. produktive Infektion – in diesem Fall wird eine neue Generation von Viren gebildet.
2. abortive Infektion – in diesem Fall kommt es aufgrund der Anwesenheit von:
Defekter Virus;
Resistente Zelle;
Virulentes Virus in geringer Dosis.
Abhängig vom Schicksal der infizierten Zelle wird außerdem unterschieden:
3. Lytische Infektion – in diesem Fall kommt es zum Zelltod und die während des Reproduktionsprozesses gebildete Generation von Viren verlässt die Zelle.
4. nicht-lytische Infektion. In diesem Fall kommt es nicht zum Zelltod und es wird auch keine Bildung einer neuen Generation von Viren beobachtet (abortive Infektion) oder es wird eine begrenzte Anzahl von Virionen gebildet, die die Zelle verlassen und nicht zu deren Tod führen (begrenzte Infektion).
Auf der Körperebene Die autonome Art der Interaktion äußert sich in folgenden Infektionen:
1. Akute Infektion, gekennzeichnet durch eine kurze Inkubationszeit, einen kurzen Verlauf, die vollständige Entwicklung klinischer Symptome und die Bildung einer Immunität. Eine akute Infektion entspricht einer autonomen produktiv-lytischen Art der Interaktion.
2. Inapparente Infektion (angl. Inapparent – unsichtbar), gekennzeichnet durch das Fehlen äußerer klinischer Anzeichen und begleitet von einer leichten Vermehrung des Virus. Die innaparente Infektion entspricht einer autonomen produktiven nichtlytischen Art der Interaktion
II. Integrationsart der Interaktion.
Bei dieser Art der Interaktion wird die Nukleinsäure des Virus in das zelluläre Genom integriert und fungiert als Teil des zellulären Genoms. Es gibt mehrere Mechanismen zur Integration viraler Nukleinsäure in das zelluläre Genom. Voraussetzung für die Genomintegration ist die Zirkularisierung der viralen Nukleinsäure (Schließung des NA-Moleküls zu einem Kreis). Dieses Phänomen wird durch das Vorhandensein zueinander komplementärer Regionen an beiden Enden der Nukleinsäurekette ermöglicht.
Die Nukleinsäure von DNA-Genomviren ist direkt in die molekulare Nukleinsäure integriert (Hepadnaviren, Papovaviren usw.). Die Nukleinsäure von RNA-Genomviren kann aufgrund von Unterschieden in ihrer chemischen Struktur nicht direkt in die Zell-DNA eingebaut werden. Dabei synthetisieren RNA-Viren (Retroviren) zunächst einen DNA-Strang an einer RNA-Kette. Eine solche umgekehrte Synthese von Nukleinsäuren ist nur aufgrund der Anwesenheit eines speziellen Enzyms in der Zusammensetzung der Retrovirus-Virionen möglich.
In das zelluläre Genom integrierte virale Nukleinsäure kann sehr lange (bis zu mehreren Jahren) bestehen bleiben. Dieser Zustand der längeren Präsenz des viralen Genoms in der Zelle wird Persistenz genannt. In diesem Fall ändern sich die vererbten Eigenschaften der Zelle.
Ein Abschnitt einer komplexen Nukleinsäure, der eine virusspezifische Nukleotidsequenz enthält, wird als Provirus bezeichnet. Unter bestimmten Bedingungen wird das Provirus aktiviert, das heißt, es wird eine neue Generation von Virionen gebildet, die die infizierte Zelle verlassen.
Auf Zellebene Die Integrationsart der Interaktion kann auch folgende Formen annehmen:
1. produktive Infektion
2. fehlgeschlagene Infektion
3. Lytische Infektion
4. nicht-lytische Infektion.
Auf der Körperebene Die Interaktion vom Integrationstyp tritt in Form folgender Infektionen auf:
1. Chronische Infektion, gekennzeichnet durch einen langen Verlauf, die Entwicklung klinischer Symptome geringer Intensität und die Bildung einer nicht sterilen Immunität.
2. Latente Infektion, gekennzeichnet durch eine lange asymptomatische Periode (Persistenz) mit periodischer Verschlimmerung des Infektionsprozesses unter dem Einfluss verschiedener Faktoren.
3. Eine langsame Infektion, die durch prävirale Partikel – Prionen – verursacht wird und durch eine sehr lange (bis zu mehreren Jahren) Inkubationszeit mit dem anschließenden Übergang des Infektionsprozesses in die akute Phase gekennzeichnet ist, wobei das Nervensystem nicht entzündlich geschädigt wird Natur und der unveränderliche Tod des Körpers.
Eine akute Infektion ist eine Infektion, die durch eine kurze Inkubationszeit, die vollständige Entwicklung klinischer Symptome und die Genesung oder den Tod gekennzeichnet ist. Bei akuten Virusinfektionen wird ein vollständiger Zyklus der Virusvermehrung mit der Freisetzung reifer Virionen aus der betroffenen Zelle und ihrem anschließenden Tod beobachtet. Eine akute Infektion entspricht einer autonomen produktiven lytischen Interaktion des Virus mit der Zelle.
Für eine akute Infektion sind ein virulentes Virus und eine empfindliche Zelle erforderlich. Zu den Stadien der Virusvermehrung bei dieser Art von Infektion gehören:
ADSORPTION– Anheftung des Viruspartikels an die Zelloberfläche.
Zur Adsorption nutzen Viren physiologische Regulationsrezeptoren, die für das Zellleben notwendig sind.
Typischerweise erfolgt die Interaktion und Adsorption des Virus durch zufälligen Kontakt des Virions mit einem Protein an der Rezeptorstelle der Zytoplasmamembran der Zelle, meist einem Glykoprotein. Das Vorhandensein dieser Rezeptoren bestimmt die Spezifität (Tropismus) des Virus. Diese Proteine sind häufig Rezeptoren für die Bindung physiologischer Hormone und anderer biologisch aktiver Substanzen (z. B. bindet das Tollwutvirus an die neuronalen Rezeptoren, die für die Bindung von Acetylcholin verantwortlich sind, das Pockenvirus bindet an Epithelzellrezeptoren für die Bindung des epidermalen Zellwachstumsfaktors).
Das Virion enthält außerdem spezifische Proteine, die die Anlagerung erleichtern. Dies können spezielle Vertiefungen am Kapsid (Enteroviren) oder Proteinvorsprünge an den Ecken des Ikosaeders (Adenoviren) oder Spitzen am Superkapsid (Influenzaviren) sein.
Wenn sich das Virus an ungewöhnliche Rezeptoren bindet, kommt es nicht zu einer Infektion der Zelle.
Penetration und Deprotenisierung von Virionen– Eindringen des Virus in das Zytoplasma der Zelle.
Das Eindringen des Virus erfolgt unmittelbar nach der Adsorption. Der Penetrationsmechanismus ist für verschiedene Viren unterschiedlich. So reicht bei einigen Viren die Penetration einer Nukleinsäure aus, während bei anderen ein Mechanismus erforderlich ist, der zusammen mit der Nukleinsäure die Penetration von Virion-Enzymen gewährleistet, die für die weitere Vermehrung von Viren notwendig sind (RNA-abhängige DNA-Polymerasen). ). Im Allgemeinen kann dieser Vorgang einige Minuten bis mehrere Stunden dauern.
Derzeit sind drei Penetrationsmechanismen (Eindringen in das Zytoplasma) von Viren bekannt:
1. Penetrationsmechanismus, der für kleine, einfach organisierte Viren charakteristisch ist. In diesem Fall dringt nach der Adsorption des Kapsids an der Zytoplasmamembran der Zelle nur die virale Nukleinsäure in diese ein.
2. Der Penetrationsmechanismus, der für einzelne komplexe Viren (Paramyxoviren, Orthomyxoviren) charakteristisch ist. In diesem Fall integriert sich das Superkapsid aufgrund seiner starken Ähnlichkeit mit der Zytoplasmamembran der Zelle und das nackte Kapsid mit der Virus-RNA und der virusspezifischen Polymerase dringt in die Zelle ein.
3. Penetrationsmechanismus, charakteristisch für die meisten komplexen Viren. In diesem Fall dringt das vollständige Viruspartikel durch Endozytose in die Zelle ein, gefolgt von der Bildung eines Vesikels ( Receptosomen). Dieses Phänomen nennt man viropexis. In diesem Fall bindet das Virion an ein spezielles Zelloberflächenprotein – Clathrin. Die resultierenden Vesikel werden von der Zytoplasmamembran getrennt und gelangen in das Zytoplasma. Anschließend verschmelzen die Vesikel mit Lysosomen, deren Enzyme das Virus enthüllen; seltener integriert sich das Superkapsid in die Lysosomenmembran, gefolgt von der Freisetzung des Kapsids in das Zytoplasma der Zelle.
TRANSKRIPTION, AUSSTRAHLUNG– Umschreiben von Informationen von DNA in RNA, Proteinsynthese auf einem RNA-Molekül.
Der Transkriptionsmechanismus ist für RNA- und DNA-Genomviren unterschiedlich.
Bei DNA-Genomviren bildet die Matrizen-DNA selbst die mRNA. Die meisten DNA-Viren verwenden ein zelluläres Enzym, weshalb die Transkription und Replikation dieser Viren im Zellkern erfolgt. Bei Viren der Familie Poxviridae erfolgt die Transkription unter Beteiligung eines viralen Enzyms (DNA-abhängige RNA-Polymerase), das Teil des Virions ist und zusammen mit der viralen Nukleinsäure in die Zelle eindringt. In diesem Fall benötigt das Virus keine zellulären Enzyme und vermehrt sich im Zytoplasma der Zelle.
Der Lebenszyklus aller DNA-Genomviren folgt dem folgenden Muster:
DNA® mRNA® Protein.
Die Transkription genomischer RNA-Viren kann aufgrund des Vorhandenseins unterschiedlicher RNA-Typen in einzelnen Viren nach unterschiedlichen Mechanismen erfolgen (einzelsträngige RNA mit positivem Genom, einzelsträngige RNA mit negativem Genom, doppelsträngige RNA).
Bei manchen Viren (Picornaviren etc.) übernimmt die virale RNA selbst die Funktion der mRNA. Diese Art von Nukleinsäure wird als positiv bezeichnet. In diesem Fall bindet die RNA des Virus an die Ribosomen der Zelle und der Translationsprozess beginnt. An Ribosomen wird ein riesiges Polypeptidmolekül synthetisiert, das dann in einzelne Fragmente gespalten wird. Diese Fragmente werden unter der Wirkung von Zell- und Virion-Enzymen modifiziert, und solche modifizierten Polypeptidmoleküle sind vollständige virale Proteine. Der Lebenszyklus solcher Viren folgt dem folgenden Muster: RNA®-Protein.
RNA-genomische Viren mit negativem Genom (Paramyxoviren) nutzen zur Transkription eine RNA-abhängige Polymerase, die Teil des Virions ist. Dieses Enzym baut einen komplementären +-RNA-Strang auf dem –-RNA-Strang auf, der dann in die Ribosomen gelangt und der Prozess der Translation des viralen Proteins beginnt. Der Lebenszyklus solcher Viren folgt dem folgenden Muster:
RNA® i-RNA® Protein.
Bei RNA-Genomviren mit einem doppelsträngigen RNA-Molekül (Reoviren) teilt die Virion-Transkriptase das Molekül und synthetisiert mRNA am Minusstrang. Der Lebenszyklus solcher Viren verläuft ebenfalls nach folgendem Muster:
RNA® i-RNA® Protein.
Zur Gruppe der RNA-Genomviren gehört die Familie der Retroviridae, die einen besonderen Lebenszyklus aufweist. Bei solchen Viren beginnt der Transkriptionsprozess mit der Synthese des Minus-DNA-Strangs am Plus-RNA-Strang. Dieser Prozess erfolgt unter Beteiligung des Enzyms RNA-abhängige DNA-Polymerase. Diese Synthese erfolgt in zwei Phasen: Zuerst wird ein RNA-DNA-Hybrid gebildet, dann wird der RNA-Strang des Hybrids zerstört und der DNA-Strang freigesetzt. Anschließend wird an diesem Strang ein zweiter DNA-Strang (provirale DNA) vervollständigt, auf dem dann mRNA synthetisiert wird. Der Lebenszyklus solcher Viren folgt dem folgenden Muster: RNA ® DNA ® mRNA ® Protein
Unter Translation versteht man den Prozess der Übersetzung genetischer Informationen in eine spezifische Aminosäuresequenz eines Proteins. Es erfolgt in mehreren Phasen:
Einleitung. Der Prozess der Erkennung von mRNA durch das Ribosom und deren Bindung. Die Translation beginnt, wenn das Ribosom an das Initiationscodon bindet, und hier werden Initiationsproteine angebracht, um den Translationsprozess zu regulieren. Das Virus führt auch seine eigenen Inhibitorproteine ein, die die Translation zellulärer mRNA hemmen;
Elongation – Verlängerung einer Polypeptidkette;
Termination ist die Beendigung der Translation, wenn das Ribosom das Stoppcodon erreicht.
REPRODUZIEREN– Synthese neuer Virus-Nukleinsäuremoleküle.
Die Replikation von DNA-Genomviren erfolgt entweder unter Beteiligung zellulärer Enzyme oder ihrer eigenen virusspezifischen Enzyme. Bei kleinen genomischen DNA-Viren (Parvoviren) enthält das Nukleinsäuremolekül eine begrenzte Anzahl von Genen (3), die für Strukturproteine kodieren. Daher wird ein zelluläres Enzym zur Replikation viraler DNA verwendet. Bei größeren Viren reicht die Nukleinsäuregröße aus, um sowohl strukturelle als auch funktionelle Proteine zu kodieren. Beispielsweise enthält die Nukleinsäure von Herpesviren etwa 100 Gene, von denen einige Enzyme kodieren, die für die virale DNA-Replikation notwendig sind. Daher sind die ersten synthetisierten Proteine im Prozess der Transkription und Translation virusspezifische Polymerasen.
Der Replikationsmechanismus von RNA-Genomviren ist unterschiedlich. Bei Viren, die ein einzelsträngiges RNA-Molekül enthalten, wird unter Beteiligung viraler Enzyme temporäre doppelsträngige RNA (replikative Form) synthetisiert: Bei Viren mit negativem Genom wird der +-Strang vervollständigt, bei Viren mit positivem Genom der – Strang ist fertig. Anschließend wird die replikative RNA in zwei Stränge aufgeteilt, auf denen jeweils neue doppelsträngige replikative RNA-Moleküle synthetisiert werden, und der Vorgang wird wiederholt, bis eine ausreichende Anzahl von Kopien der RNA-Moleküle gebildet ist. Dieser Prozess läuft parallel zur Synthese viraler Proteine ab, bis eine neue Generation von Viren die betroffene Zelle verlässt.
Bei RNA-Genomviren, die doppelsträngige RNA enthalten, wird das Nukleinsäuremolekül durch separate Fragmente dargestellt, von denen jedes ein separates mRNA-Molekül kodiert. Am Ende des Translationszyklus werden alle mRNA-Moleküle vorübergehend kombiniert und unter Beteiligung der Replikase doppelsträngige RNA synthetisiert.
VIRION-MONTAGE. Späte Gene aller Viren kodieren Strukturproteine des Kapsids. Zunächst werden Prokapside gebildet, also unreife Kapside ohne Nukleinsäure. Anschließend wird die Nukleinsäure des Virus in die Prokapsiden eingefügt und so ein reifes Virion gebildet. Bei kleinen RNA-Genomviren erfolgen die Synthese von RNA, Protein und deren Assoziation gleichzeitig. Bei Pockenviren ist der Virion-Assemblierungsprozess komplexer. Ihr Virus umfasst zelluläre Bestandteile – einzelne Abschnitte der Zytoplasmamembran.
Viren verfügen über eine getrennte (disjunktive) Synthese von Protein und Nukleinsäure.
AUSTRITT DES VIRUS AUS DER ZELLE. Einfach organisierte Viren verlassen die Zelle durch einfache Lyse der Wirtszelle. Bei komplexen Viren erfolgt die Bildung eines Superkapsids im Moment des Austritts aus der Zelle. In diesem Fall wird das Nukleokapsid in die Zytoplasmamembran eingefügt. Durch die Knospung entsteht dann das Superkapsid des Virus, das das Kapsid im Moment der Ablösung von der Zelloberfläche bedeckt.
Eine Infektion einer Zelle mit einem Virus kann zur Entwicklung pathologischer Veränderungen in der Zelle führen. Durch die Vermehrung in der Zelle verursacht das Virus das Auftreten von CPE und CPE. Dies ist eine spezifische morphologische Zerstörung (CPD) oder eine funktionelle Pathologie ohne Zerstörung (CPE).
Viren, die das Auftreten von CPD verursachen, werden als zytopathisch bezeichnet.
Eine lytische (zytozide) Infektion ist eine Infektionsart, bei der morphologische Veränderungen in der infizierten Zelle beobachtet werden, gefolgt von deren Zerstörung und Tod. Das Virus während einer zytoziden Infektion zeichnet sich durch eine hohe Produktion aus.
Es sind mehrere Mechanismen der Zellschädigung durch Viren bekannt:
1. Viele Viren hemmen die Synthese zellulärer DNA, RNA und Proteine. Bestimmte zytozide Viren (Picornaviren, Herpesviren, Adenoviren) sind in dieser Hinsicht äußerst aktiv. Jedoch. Der Mechanismus der Hemmung des Zellstoffwechsels ist noch nicht klar.
2. Während des Prozesses der intrazellulären Reproduktion kann die Zerstörung von Lysosomen in dem Stadium auftreten, in dem das Virus sie in das Zytoplasma der Zelle verlässt. Dies führt zur Freisetzung hydrolytischer Enzyme und anschließender Zellzerstörung.
3. Eine Infektion einer Zelle mit Viren kann aufgrund der Integration virusspezifischer Proteine in diese zu einer erheblichen Störung der Struktur der Zytoplasmamembran führen. Dies führt zu einem Angriff des körpereigenen Immunsystems auf die infizierte Zelle. Bei vielen durch Herpesviren verursachten Infektionen verschmelzen 50-100 Zellen zu einer Riesenzelle, die vom körpereigenen Immunsystem angegriffen wird.
4. Hohe Konzentrationen viraler Proteine, wie sie bei Influenza und anderen Infektionen beobachtet werden, haben eine ausgeprägte toxische Wirkung auf die Zelle.
5. Bei vielen Virusinfektionen kommt es zur Bildung intrazellulärer Einschlüsse, die auf die Konzentration viraler Partikel oder ihrer Proteine im Zellkern oder Zytoplasma zurückzuführen sind. Oft führen intrazelluläre Einschlüsse direkt zum Zelltod.
6. Herpesviren und einige andere verursachen Störungen im Zellgenom, die zu deren Tod führen.
Am häufigsten sind mehrere der oben genannten Faktoren am Entstehungsmechanismus von CPP beteiligt.
Die Reaktion von Viren auf eine Infektion kann auf vier Arten erfolgen:
1. Zellschädigung und Zelltod (Bildung von CPD). Die Zellen schwellen an, nehmen eine unregelmäßige Form an und es entsteht Körnigkeit. Anschließend vergrößert es sich und es bilden sich intrazelluläre Einschlüsse. Es kann zu Schäden an der Membran oder zur Verschmelzung von Zellen zu Symplasten kommen.
2. Synthese von Interferonproteinen, die verhindern, dass das Virus gesunde Zellen infiziert.
3. Vermehrung des Virus ohne sichtbare pathologische Veränderungen in der Zelle, die bei latenten Infektionen beobachtet wird. Für sein Auftreten sind ein virulentes Virus und eine unempfindliche Zelle erforderlich.
4. Wenn ein Virus in eine Zelle eindringt, wird eine Zellproliferation beobachtet. Für sein Auftreten ist ein onkogenes Virus erforderlich, dessen Genom in das zelluläre Genom eingebettet (integriert) ist.
Der Prozess der Virusvermehrung kann grob in zwei Phasen unterteilt werden . Die erste Phase umfasst 3 Phasen: 1) Adsorption des Virus an empfindlichen Zellen; 2) Eindringen des Virus in die Zelle; 3) Deproteinisierung des Virus . Die zweite Phase umfasst die Phasen der Implementierung des viralen Genoms: 1) Transkription, 2) Translation, 3) Replikation, 4) Zusammenbau, Reifung viraler Partikel und 5) Austritt des Virus aus der Zelle.
Die Interaktion eines Virus mit einer Zelle beginnt mit dem Adsorptionsprozess, also mit der Anheftung des Virus an die Zelloberfläche.
Adsorption ist eine spezifische Bindung des Virion-Proteins (Antirezeptor) an die komplementäre Struktur der Zelloberfläche – den Zellrezeptor. Aufgrund ihrer chemischen Natur gehören die Rezeptoren, an denen Viren fixiert sind, zu zwei Gruppen: Mukoprotein und Lipoprotein. Influenzaviren, Parainfluenza und Adenoviren werden an Mukoproteinrezeptoren fixiert. Enteroviren, Herpesviren und Arboviren werden an Lipoproteinrezeptoren der Zelle adsorbiert. Die Adsorption erfolgt nur in Gegenwart bestimmter Elektrolyte, insbesondere Ca2+-Ionen, die überschüssige anionische Ladungen des Virus und der Zelloberfläche neutralisieren und die elektrostatische Abstoßung verringern. Die Adsorption von Viren hängt kaum von der Temperatur ab. Die anfänglichen Prozesse der Adsorption sind unspezifischer Natur und werden auch in der Umgebung von Viren verwendet das Ergebnis einer elektrostatischen Wechselwirkung positiv und negativ geladener Strukturen auf der Oberfläche des Virus und der Zelle. Anschließend kommt es zu einer spezifischen Wechselwirkung zwischen dem Virion-Anheftungsprotein und bestimmten Gruppen auf der Plasmamembran der Zelle. Einfache menschliche und tierische Viren enthalten als Teil des Kapsids Bindungsproteine. Bei komplexen Viren sind Bindungsproteine Teil des Superkapsids. Sie können die Form von Filamenten (Fasern bei Adenoviren) oder Spitzen, pilzähnlichen Strukturen bei Myxo-, Retro-, Rhabdo- und anderen Viren, annehmen. Zunächst erfolgt eine einzelne Verbindung des Virions mit dem Rezeptor – eine solche Bindung ist fragil – die Adsorption ist reversibel. Damit eine irreversible Adsorption erfolgt, müssen mehrere Verbindungen zwischen dem Virusrezeptor und dem Zellrezeptor auftreten, d. h. eine stabile multivalente Bindung. Die Anzahl spezifischer Rezeptoren auf der Oberfläche einer Zelle beträgt 10 4 -10 5. Rezeptoren für einige Viren, zum Beispiel Arboviren. sind auf den Zellen sowohl von Wirbeltieren als auch von Wirbellosen enthalten; bei anderen Viren nur auf den Zellen einer oder mehrerer Arten.
Das Eindringen menschlicher und tierischer Viren in Zellen erfolgt auf zwei Arten: 1) Viropexis (Pinozytose); 2) Fusion der viralen Superkapsidhülle mit der Zellmembran. Bakteriophagen verfügen über einen eigenen Penetrationsmechanismus, die sogenannte Spritze, bei der durch Kontraktion des Proteinanhangs des Phagen die Nukleinsäure in die Zelle injiziert wird.
Die Deproteinisierung des Virus, die Freisetzung des Virushämoms aus den Virusschutzhüllen, erfolgt entweder mit Hilfe viraler Enzyme oder mit Hilfe zellulärer Enzyme. Die Endprodukte der Deproteinisierung sind Nukleinsäuren oder mit dem internen Virusprotein assoziierte Nukleinsäuren. Dann findet die zweite Phase der Virusreproduktion statt, die zur Synthese viraler Komponenten führt.
Unter Transkription versteht man das Umschreiben von Informationen aus der DNA oder RNA eines Virus in mRNA gemäß den Gesetzen des genetischen Codes.
Unter Translation versteht man den Prozess der Übersetzung genetischer Informationen, die in mRNA enthalten sind, in eine bestimmte Aminosäuresequenz.
Replikation ist der Prozess der Synthese von Nukleinsäuremolekülen, die zum viralen Genom homolog sind.
Die Umsetzung genetischer Informationen in DNA-haltigen Viren erfolgt auf die gleiche Weise wie in Zellen:
DNA-Transkription mRNA-Translationsprotein
RNA-Transkription i-RNA-Translationsprotein
Bei Viren mit positivem RNA-Genom (Togaviren, Picornaviren) fehlt die Transkription:
RNA-Protein-Translation
Retroviren verfügen über eine einzigartige Möglichkeit, genetische Informationen zu übertragen:
RNA-Reverse-Transkription, DNA-Transkription, mRNA-Translationsprotein
Die DNA integriert sich in das Genom der Wirtszelle (Provirus).
Nachdem die Zelle virale Komponenten angesammelt hat, beginnt die letzte Phase der viralen Reproduktion: der Zusammenbau viraler Partikel und die Freisetzung von Virionen aus der Zelle. Virionen verlassen die Zelle auf zwei Arten: 1) indem sie die Zelle „explodieren“ lassen, wodurch die Zelle zerstört wird. Dieser Weg ist einfachen Viren (Picorna-, Reo-, Papova- und Adenoviren) inhärent, 2) der Austritt aus Zellen durch Knospung. Inhärent in Viren, die ein Superkapsid enthalten. Bei dieser Methode stirbt die Zelle nicht sofort ab und kann mehrere virale Nachkommen produzieren, bis ihre Ressourcen erschöpft sind.
Methoden zur Viruskultivierung
Zur Kultivierung von Viren unter Laborbedingungen werden folgende lebende Objekte verwendet: 1) Zellkulturen (Gewebe, Organe); 2) Hühnerembryonen; 3) Labortiere.
Zellkultur
Am gebräuchlichsten sind einschichtige Zellkulturen, die in 1) primäre (hauptsächlich trypsinierte), 2) halbkontinuierliche (diploide) und 3) kontinuierliche Zellkulturen unterteilt werden können.
Nach Herkunft Sie werden in embryonale, Tumor- und erwachsene Organismen eingeteilt. durch Morphogenese- fibroblastisch, epithelial usw.
Primär Zellkulturen sind Zellen jeglichen menschlichen oder tierischen Gewebes, die die Fähigkeit besitzen, in Form einer Monoschicht auf einer mit einem speziellen Nährmedium beschichteten Kunststoff- oder Glasoberfläche zu wachsen. Die Lebensdauer solcher Pflanzen ist begrenzt. Im Einzelfall werden sie nach mechanischer Zerkleinerung, Behandlung mit proteolytischen Enzymen und Standardisierung der Zellzahl aus dem Gewebe gewonnen. Aus Affennieren, menschlichen embryonalen Nieren, menschlichem Amnion und Hühnerembryonen gewonnene Primärkulturen werden häufig zur Isolierung und Anreicherung von Viren sowie zur Herstellung viraler Impfstoffe verwendet.
Halbleder (oder diploid ) Zellkulturen – Zellen des gleichen Typs, die in vitro bis zu 50–100 Passagen überstehen können und dabei ihren ursprünglichen diploiden Chromosomensatz beibehalten. Diploide Stämme menschlicher embryonaler Fibroblasten werden sowohl zur Diagnose viraler Infektionen als auch bei der Herstellung viraler Impfstoffe verwendet.
Kontinuierlich Zelllinien zeichnen sich durch potenzielle Unsterblichkeit und einen heteroploiden Karyotyp aus.
Die Quelle transplantierbarer Linien können primäre Zellkulturen (z. B. SOC, PES, BHK-21 – aus den Nieren eintägiger syrischer Hamster; PMS – aus der Niere eines Meerschweinchens usw.) einzelner Zellen von sein die eine Tendenz zur endlosen Reproduktion in vitro zeigen. Die Reihe von Veränderungen, die zum Auftreten solcher Merkmale in Zellen führen, wird als Transformation bezeichnet, und die Zellen kontinuierlicher Gewebekulturen werden als transformiert bezeichnet.
Eine weitere Quelle transplantierbarer Zelllinien sind bösartige Neubildungen. In diesem Fall erfolgt die Zelltransformation in vivo. Die folgenden Linien transplantierter Zellen werden in der virologischen Praxis am häufigsten verwendet: HeLa – gewonnen aus Gebärmutterhalskrebs; Ner-2 – vom Kehlkopfkarzinom; Detroit-6 – von der Metastasierung des Lungenkrebses bis zum Knochenmark; RH – aus der menschlichen Niere.
Zur Kultivierung von Zellen werden Nährmedien benötigt, die je nach Verwendungszweck in Wachstums- und Stützmedien unterteilt werden. Wachstumsmedien müssen mehr Nährstoffe enthalten, um eine aktive Zellproliferation zur Bildung einer Monoschicht sicherzustellen. Unterstützende Medien sollen lediglich dafür sorgen, dass Zellen während der Vermehrung von Viren in der Zelle in einer bereits gebildeten Monoschicht überleben.
Standardmäßige synthetische Medien wie synthetische Medien 199 und Eagle-Medien werden häufig verwendet. Unabhängig vom Zweck werden alle Zellkulturmedien mit einer ausgewogenen Salzlösung formuliert. Am häufigsten handelt es sich um die Hanks-Lösung. Ein integraler Bestandteil der meisten Wachstumsmedien ist tierisches Blutserum (Kalb, Rind, Pferd), ohne 5-10 % davon findet keine Zellreproduktion und Monoschichtbildung statt. Serum ist nicht in den Wartungsmedien enthalten.
Isolierung von Viren in Zellkulturen und Methoden zu ihrer Indikation.
Bei der Isolierung von Viren aus verschiedenen infektiösen Materialien eines Patienten (Blut, Urin, Kot, Schleimausscheidungen, Organwaschungen) werden Zellkulturen verwendet, die am empfindlichsten auf das vermutete Virus reagieren. Zur Infektion werden Kulturen in Reagenzgläsern mit einer gut entwickelten Monoschicht von Zellen verwendet. Vor der Infektion der Zellen wird das Nährmedium entfernt und in jedes Reagenzglas 0,1-0,2 ml einer Suspension des Testmaterials gegeben, die mit Antibiotika zur Abtötung von Bakterien und Pilzen vorbehandelt wurde. Nach 30-60 Min. Nach Kontakt des Virus mit Zellen wird überschüssiges Material entfernt, ein Trägermedium in das Reagenzglas gegeben und in einem Thermostat belassen, bis Anzeichen einer Virusreplikation festgestellt werden.
Ein Indikator für das Vorhandensein eines Virus in infizierten Zellkulturen kann sein:
1) die Entwicklung einer spezifischen Zelldegeneration – die zytopathische Wirkung des Virus (CPE), die drei Haupttypen aufweist: runde oder kleinzellige Degeneration; Bildung mehrkerniger Riesenzellen – Symplasten; Entwicklung von Zellproliferationsherden, bestehend aus mehreren Zellschichten;
2) Nachweis intrazellulärer Einschlüsse im Zytoplasma und in den Kernen betroffener Zellen;
3) positive Hamagglutinationsreaktion (RHA);
4) positive Hämadsorptionsreaktion (RHAds);
5) Phänomen der Plaquebildung: Eine Monoschicht virusinfizierter Zellen wird mit einer dünnen Schicht Agar unter Zusatz eines neutralen roten Indikators (Hintergrund – rosa) bedeckt. Bei Vorhandensein eines Virus bilden sich auf dem rosafarbenen Agarhintergrund in den Zellen farblose Zonen („Plaques“).
6) In Abwesenheit von CPD oder GA kann eine Interferenzreaktion durchgeführt werden: Die untersuchte Kultur wird erneut mit dem Virus infiziert, das CPD verursacht. Im positiven Fall findet kein CPP statt (die Interferenzreaktion ist positiv). Wenn im Testmaterial kein Virus vorhanden war, wird CPE beobachtet.
Isolierung von Viren in Hühnerembryonen.
Für virologische Studien werden Hühnerembryonen im Alter von 7–12 Tagen verwendet.
Vor der Infektion wird die Lebensfähigkeit des Embryos bestimmt. Bei der Ovoskopie sind lebende Embryonen beweglich und das Gefäßmuster ist deutlich sichtbar. Die Grenzen des Luftsacks werden mit einem einfachen Bleistift markiert. Hühnerembryonen werden unter aseptischen Bedingungen mit sterilen Instrumenten infiziert, nachdem die Schale über dem Luftraum mit Jod und Alkohol vorbehandelt wurde.
Die Methoden zur Infektion von Hühnerembryonen können unterschiedlich sein: Aufbringen des Virus auf die Chorion-Allantois-Membran, in die Amnion- und Allantoishöhlen, in den Dottersack. Die Wahl der Infektionsmethode hängt von den biologischen Eigenschaften des untersuchten Virus ab.
Hinweise auf das Virus in einem Hühnerembryo geben der Tod des Embryos, eine positive Hämagglutinationsreaktion auf Glas mit Allantois- oder Fruchtwasser sowie fokale Läsionen („Plaques“) auf der Chorion-Allantois-Membran.
III. Isolierung von Viren in Labortieren.
Labortiere können zur Isolierung von Viren aus infektiösem Material verwendet werden, wenn geeignetere Systeme (Zellkulturen oder Hühnerembryonen) nicht verwendet werden können. Sie nehmen hauptsächlich neugeborene weiße Mäuse, Hamster, Meerschweinchen und Rattenwelpen auf. Die Infektion der Tiere erfolgt nach dem Prinzip des Viruszytotropismus: Pneumotrope Viren werden intranasal, neurotrope Viren – intrazerebral, dermatotrope Viren – auf die Haut injiziert.
Die Indikation für das Virus beruht auf dem Auftreten von Krankheitszeichen bei Tieren, deren Tod, pathomorphologischen und pathohistologischen Veränderungen in Geweben und Organen sowie einer positiven Hämagglotinierungsreaktion bei Organextrakten.
Reproduktion von Viren. Interaktion mit dem Eigentümer. Anbau.
Viren vermehren sich nicht durch binäre Spaltung. In den 50er Jahren des 20. Jahrhunderts. Es wurde festgestellt, dass die Vermehrung von Viren durch Reproduktion erfolgt. reproduzieren– reproduzieren, eine Kopie erstellen), d.h. durch die Reproduktion ihrer Nukleinsäuren und Proteinsynthese, gefolgt vom Zusammenbau von Virionen. Diese Prozesse finden in verschiedenen Teilen der Wirtszelle statt (z. B. im Zellkern und im Zytoplasma). Diese unzusammenhängende Reproduktionsmethode wird als disjunktiv bezeichnet. Die Reproduktion von Viren ist durch einen sequentiellen Wechsel einzelner Stadien gekennzeichnet:
1) Adsorption. Das Eindringen eines Viruspartikels in eine Zelle beginnt mit seiner Adsorption an der Zelloberfläche aufgrund der Interaktion von zellulären und viralen Rezeptoren. Rezeptoren (lat. Rezeptor- Empfangen) - empfindliche Sonderformationen, die Reizungen wahrnehmen; dabei handelt es sich um Moleküle oder Molekülkomplexe auf der Oberfläche von Zellen, die in der Lage sind, bestimmte chemische Gruppen, Moleküle oder andere Zellen zu erkennen und zu binden. Bei komplexen Virionen befinden sich die Rezeptoren in Form von spitzenartigen Vorsprüngen oder Zotten auf der Außenhülle; bei einfachen Virionen befinden sie sich auf der Oberfläche des Kapsids.
2) Eindringen des Virions in die Wirtszelle. Die Art und Weise, wie Viren in die für sie empfindlichen Zellen eindringen, ist nicht die gleiche. Viele Virionen können durch Pinozytose (griech.) in die Zelle gelangen. Pino- trinken, trinken), wenn die entstehende pinozytäre Vakuole das Virion in die Zelle zieht. Andere Virionen können direkt durch ihre Membran in die Zelle eindringen.
3) Zerfall(oder „Entkleiden“) des Virions – Freisetzung des NK aus der Außenhülle und dem Kapsid. Nachdem das Virion in die Zelle eingedrungen ist, verändert sich das Kapsid, wird empfindlich gegenüber zellulären Proteasen und wird zerstört, wodurch das NK freigesetzt wird. Bei einigen Bakteriophagen dringt freies NK in die Zelle ein. Phytopathogene Viren dringen durch Schäden in der Zellwand ein, werden anschließend an interne Zellrezeptoren adsorbiert und NK wird freigesetzt.
4) Synthese viraler Proteine und NK-Replikation. Die Synthese virusspezifischer Proteine erfolgt unter Beteiligung von Boten-RNAs (bei einigen Viren sind sie Teil von Virionen, während sie bei anderen in infizierten Zellen auf einer Matrix aus Virion-RNA oder -DNA synthetisiert werden). Es findet eine virale NK-Replikation statt.
5) Zusammenbau oder Morphogenese des Virions. Die Bildung von Virionen ist nur unter der Bedingung einer streng geordneten Verbindung viraler Strukturpolypeptide und ihrer NK möglich, die durch die Selbstorganisation von Proteinmolekülen um die NK herum sichergestellt wird
6) Freisetzung des Virions aus der Wirtszelle. Viruspartikel verlassen die Zelle gleichzeitig (mit Zellzerstörung) oder allmählich (ohne Zellzerstörung).
Die Vermehrung des Virus in einer Zelle erfolgt in mehreren Phasen:
· Die erste Phase ist die Adsorption des Virus an der Oberfläche einer für dieses Virus empfindlichen Zelle.
· Die zweite Phase ist das Eindringen des Virus in die Wirtszelle durch Viropexis.
· Die dritte Phase ist das „Entkleiden“ der Virionen, die Freisetzung der Virus-Nukleinsäure aus dem Superkapsid und dem Kapsid. Bei einer Reihe von Viren erfolgt das Eindringen von Nukleinsäure in die Zelle durch die Verschmelzung der Virionhülle und der Wirtszelle. In diesem Fall werden die zweite und dritte Phase zu einer zusammengefasst.
Adsorption von Virionen an der Zelle. Der Mechanismus der Adsorption von Virionen an einer anfälligen Zelle basiert auf der Interaktion ihrer Rezeptoren mit komplementären Rezeptoren der Zelle. Zell- und Virionrezeptoren sind spezifische Strukturen, die sich auf ihrer Oberfläche befinden. Myxoviren und Adenoviren werden an Mukoproteinrezeptoren adsorbiert, und Picornaviren und Arboviren werden an Lipoproteinrezeptoren adsorbiert. Neuraminidase im Myxovirus-Virion zerstört Mucogphothein-Rezeptoren und spaltet N-Acetylneuraminsäure von einem Oligosaccharid ab, das Galactosamin und Galactose enthält. Ihre Wechselwirkungen in diesem Stadium sind reversibel, da sie von Temperatur, Salzbestandteilen und der Reaktion der Umgebung beeinflusst werden. Die Adsorption des Virions an der Zelle wird durch sulfatierte Polysaccharide und Heparin, die eine negative Ladung tragen, verhindert, ihre hemmende Wirkung wird jedoch durch Polycartionen (DEAE-Dextran, Ecmolin, Protaminsulfat) aufgehoben, die die negative Ladung sulfatierter Polysaccharide neutralisieren.
Eindringen des Virions in die Zelle. Der Prozess des Eindringens von Virionen in die Zelle erfolgt bei Myxoviren durch das Enzym Neuraminidase, das in direkten Kontakt mit den Mukoproteinen der Zelle kommt. In den letzten Jahren gesammelte wissenschaftliche Erkenntnisse zeigen, dass die RNA und DNA von Virionen nicht von ihrer Außenhülle getrennt werden, d. h. die Virionen dringen vollständig durch Viropexis oder Pinozytose in die empfindliche Zelle ein. Dies wurde für Pocken, Vaccinia und andere tierische Viren nachgewiesen. Phagen infizieren Zellen mit ihrer Nukleinsäure. Der Infektionsmechanismus beruht darauf, dass in Zellvakuolen enthaltene Virionen durch Enzyme (Proteasen, Lipasen) hydrolysiert werden. Dabei wird DNA aus der Außenhülle des Phagen freigesetzt und dringt in die Zelle ein.
Im Experiment werden Zellen mit Nukleinsäure infiziert, die aus einigen Viren isoliert wurde, und es kommt zu einem Reproduktionszyklus von Virionen. Unter natürlichen Bedingungen kommt es jedoch nicht zu einer Übertragung der Infektion mit Hilfe infektiöser Säure.
Synthese viraler Strukturkomponenten. Die Prozesse der Synthese von Komponenten von RNA-Viren finden nach dem Eindringen von Nukleoproteinen (Virionen) in die Zelle statt, wo virale Polysome durch Komplexierung viraler RNA mit Ribosomen gebildet werden. Dann werden frühe Proteine synthetisiert: Repressoren des Zellstoffwechsels und RNA-Polymerasen, die mit dem ursprünglichen viralen RNA-Molekül übersetzt werden. Im Zytoplasma kleiner Viren oder im Zellkern (Influenzaviren) entsteht doppelsträngige virale RNA durch Kombination des elterlichen „Plus“-Strangs mit einem neu synthetisierten und komplementären „Minus“-Strang. Die Verbindung dieser Nukleinsäurestränge führt zur Bildung einer einzelsträngigen RNA-Struktur, der sogenannten replikativen Form (RF), die resistent gegen RNase ist und für die Reproduktion aller RNA-Viren notwendig ist. Die Synthese viraler RNA erfolgt durch einen Replikationskomplex, der das Enzym RNA-Polymerase, Polysomen und die replikative Form der RNA umfasst. Es gibt zwei Arten von RNA-Polymerasen: RNA-Polymerase I katalysiert die Bildung einer replikativen Form auf einer Plusstrang-Matrize; RNA-Polymerase II ist an der Synthese viraler einzelsträngiger RNA auf einer replikativen Formvorlage beteiligt. Die Nukleinsäuresynthese findet bei kleinen Viren im Zytoplasma statt. Das Influenzavirus synthetisiert RNA und internes Protein im Zellkern. RNA verlässt den Zellkern und gelangt in das Zytoplasma, wo sie das virale Protein mit Ribosomen synthetisiert und das resultierende Ribonukleoprotein in die chemische Zusammensetzung des Virions eingeht.
Synthese von DNA-Viruskomponenten. Nachdem Virionen in die Zelle gelangt sind, wird die Synthese von Nukleinsäuren und zellulären Proteinen unterdrückt. Im Zellkern wird mRNA auf der Matrix des DNA-Virus synthetisiert und trägt Informationen für die Proteinsynthese. Der Mechanismus der Synthese viraler Proteine wird an zellulären Ribosomen durchgeführt, und die Quelle ihrer Konstruktion ist der Aminosäurepool der Zelle. Die Aktivierung von Aminosäuren erfolgt durch Enzyme, mit Hilfe von mRNA werden sie auf Ribosomen (Polysomen) übertragen, wo sie sich im synthetisierten Proteinmolekül befinden.
Somit erfolgt in einer infizierten Zelle die Synthese von Nukleinsäuren und Virionproteinen als Teil eines komplexen replikativ-transkriptiven Komplexes, der offenbar durch ein bestimmtes System von Kontrollmechanismen reguliert wird.
Die Bildung des Virions erfolgt unter Beteiligung der Strukturbestandteile der Zelle. Polio-, Herpes- und Vacciniaviren werden im Zytoplasma und Adenoviren im Zellkern gebildet. Die Synthese viraler RNA und die Bildung von Nukleokapsid (S-Antigen) erfolgt im Zellkern und Hämagglutzin (V-Antigen) im Zytoplasma . Dann gelangt das S-Antigen vom Zellkern in das Zytoplasma, wo die Virionhülle gebildet wird. Das S-Antigen ist mit viralen Proteinen bedeckt, und Hämagglutinine und Neuraminidase sind im Virion enthalten. Und so entstehen die Nachkommen der Influenza Es entsteht ein Virus.
Austritt von Viren aus der Zelle. Virionen werden auf zwei Arten aus Zellen freigesetzt. Die erste Methode besteht darin, dass die Virionen, nachdem sie in der Zelle vollständig ausgereift sind, rund werden, sich in ihnen Vakuolen bilden und die Zellmembran zerstört wird; Virionen verlassen gleichzeitig und vollständig die Zelle (Ricornaviren). Diese Methode wird lytisch genannt. Die zweite Methode besteht darin, dass Virionen freigesetzt werden, wenn sie zwei bis sechs Stunden lang auf der Zytoplasmamembran reifen (Arboviren und Myxoviren). Die Freisetzung von Myxoviren aus der Zelle scheint durch Neuraminidase erleichtert zu werden, die die Zellmembran zerstört. Bei dieser Methode werden 75–90 % der Virionen spontan in das Kulturmedium freigesetzt und die Zellen sterben nach und nach ab.